Lesioni del Laringe riassunto
Lesioni del Laringe
Le lesioni del laringe hanno una diversa presentazione clinica a seconda che siano sovraglottiche, glottiche e sottoglottiche.
- Le lesioni sovraglottiche avranno come sintomatologia, in genere, un disturbo durante la deglutizione, quindi la DISFAGIA.
- Lesioni della glottide avranno come conseguenza una modificazione del timbro della voce, quindi una DISFONIA.
- Lesioni sottoglottiche devono diventare così’ grandi da provocare una DISPNEA.
PROCESSI OCCUPANTI SPAZIO:
- NEOPLASIE
- TUBERCOLARI: determinano una flogosi produttiva
- MICOSI, che possono determinare delle lesioni granulomatose produttive che aggettano all’interno del lume.
- LEISHMANIA,
- AMILOIDOSI, che può essere sistemica o localizzata, quando è sistemica interessa tutta la mucosa, tutta la sottomucosa, il connettivo, lo stroma che sta sotto la mucosa, quindi possono essere inspessite le corde vocali, possono avere un aspetto “lardaceo”
- MRGE importante: può essere una lesione superficiale dell’epitelio che poi quando viene riparata, viene riparata da parte di un tessuto di granulazione che può essere anche ipertrofico. Questo tessuto si sviluppa come una lesione macroscopicamente mammellonata che tende a vegetare, ulcerata in parte, facilmente friabile, sanguinante
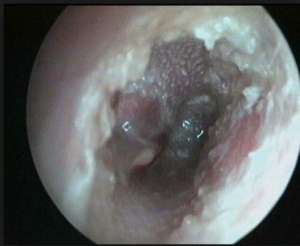
- CISTI AEREE, che sono dei diverticoli in zone di lassità maggiore dello stroma sottomucoso, sotto i colpi di tosse specialmente, durante la fonazione, il canto, un utilizzo intensivo della voce; questa mucosa tende a estroflettersi portandosi dietro del connettivo e a formare a volte una vera e propria cisti ripiena di aria che si gonfia sotto i colpi di tosse o durante la fonazione; può determinare DISFONIA; viene asportata in toto.
NEOFORMAZIONI BENIGNE LARINGE
- POLIPI LARINGEI
DEFINIZIONE: pliche di mucosa rivestite da epitelio (piatto pluristratificato)
EZIOLOGIA: sotto sforzo (es: durante il canto)→questa mucosa si estroflette e col perdurare del trauma vocale tende a diventare più grande
INCIDENZA età giovanile ma abbiamo anche i polipi dell’adulto nei soggetti anche di 50 anni.
MACROSCOPICO: In genere questa lesione è costituita da uno stroma rivestito da un epitelio pluristratificato; lo stroma può essere:
- FIBROSO (polipo fibroepiteliale con l’epitelio inspessito
- VASCOLARE (sono le ectasie venose, un polipo angioectasico, a volte vengono chiamati polipi angiomatosi)
CLINICA: anche una minuscola formazione sulla corda vocale provoca DISFONIA. (modificazione del timbro della voce).
Se persistente, bisogna subito andare a vedere se è responsabile una di queste lesioni benigne o se il responsabile è una lesione maligna localizzata all’interno della corda vocale. Se è il secondo caso, noi abbiamo una lesione maligna piccolissima, così piccola da consentire molto spesso un intervento chirurgico di tipo conservativo, non una laringectomia, ma una CORDECTOMIA anche parziale che consente quindi la preservazione delle funzione fonatoria nel soggetto e soprattutto viene prevenuta quella grossa mutilazione data dalla laringectomia total.
I polipi sono benigni e se si elimina il trauma vocale, anche con un intervento di logopedia, con l’impostazione della voce se si tratta di cantanti dilettanti, si ottiene un ottimo risultato.
La commessura anteriore è importantissima perché nel caso di un intervento conservativo per un tumore maligno noi dobbiamo osservarla perchè nel caso di una sua compromissione della commessura anteriore, la contro lateralità è indicata alla laringectomia
- PAPILLOMA SQUAMOSO LARINGE
DEFINIZIONE: Sono lesioni esofitiche friabili, localizzate a livello delle corde, con tendenza a dare recidive locali dopo l’asportazione, perchè si diffonde il virus specialmente alla regione sottoglottica e anche alla trachea e ai bronchi. Ha un comportamento benigno
INCIDENZA: è il tumore laringeo più frequente dell’infanzia, correlato all’infezione da HPV, specialmente sottotipi 6 e 11, non sono sottotipi oncogenici, però determinano questa formazione che in genere ha la caratteristica di non essere unica, quindi non abbiamo un papilloma ma abbiamo molto spesso una PAPILLOMATOSI; mentre il papilloma dell’adulto sembra non sia legato all’HPV, ed è singolo.
MICROSCOPICO: i papillomi sono degli assi connettivo-vascolari e sono rivestiti da epitelio che può mostrare degli effetti citopatici caratteristici. (vacuolizzazione perinucleare che da aspetto chiaro alle cellule)
Ha una superficie un pochino “zigrinata” un pochino frastagliata.
ISTOLOGICAMENTE: estroflessioni stromali rivestiti da cellule squamose
- TUMORI SALIVARI BENIGNI
- TUMORE MISTO (o ADENOMA PLEOMORFO LARINGE)
ORIGINE: deriva dalla componente sia dei dotti sia mioepiteliale della gh. salivare
MACROSCOPICO: formazione ben circoscritta, capsulata.
MICROSCOPICO: Un tumore a cellule granulose, con citoplasma ampio, eosinofilo (chiamati AMELOBLASTI, elementi che derivano dalla cresta neurale e che possono dare luogo a tumori sia della cute, sia della lingua).
- PARAGANGLIOMA LARINGE
Abbastanza raro (perché è più frequente quello del glomo carotideo)
SEDE: falsa corda o nella regione sottoglottica
MICROSCOPICO: struttura “organoide” , con nidi cellulari , che sono circondati da una trama contenente nervi e vasi, (sono chemocettori)
- EMANGIOMA SOTTOGLOTTICO
Tumore importante dell’infanzia
SEDE: è sottoglottico (visibile con esame in sedazione del soggetto, oltrepassando la rima della glottide; non si vede dall’esterno, si sospetta soltanto)
CLINICA: se è grosso: sintomatologia ostruttiva , con uno stridore respiratorio, però soprattutto la cosa grave è che essendo fatto proprio da una spugna di vasi, durante le crisi di pianto aumenta di dimensioni perché questi vasi si congestionano, si riempiono di sangue e allora si possono avere
anche degli episodi di apnea, di cianosi.
Può essere associato ad altre grandi malformazioni vascolari, (es: i nevi flammei del viso e del cuoio capelluto o che interessano gran parte del corpo)
EVOLUZIONE: tendenza alla regressione col crescere dell’età
- CHERATOSI LARINGEE (LEUCOPLACHIA)
CAUSA:
- fumo
- bevande alcoliche
- inquinanti ambientali e professionali.
- trauma chimico ripetuto durante MRGE
- protesi dentaria malfatta
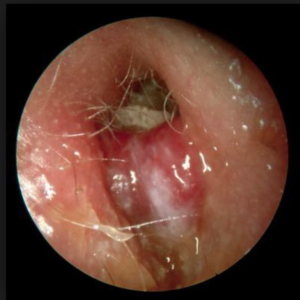
MACROSCOPICO: l’epitelio può aumentare di spessore nella zona sottoposta ad agenti nocivi, e comporta macroscopicamente placca bianca (perché l’epitelio più ispessito non fa trasparire più come di norma lo stroma vascolarizzato che c’è sotto quindi la mucosa invece di essere rosea, perché l’epitelio è abbastanza trasparente, fa trasparire il colore sottostante, in questo caso ferma la luce che viene riflessa e noi abbiamo questa impressione della placca bianca) , la leucoplachia, condizione che indica una noxa cronica che ha agito su questo epitelio, che lo ha stimolato ad accrescersi per resistere a questa noxa e quindi è sempre una condizione che può preludere la neoplasia, in quanto è espressione di una noxa cronica che agisce a lungo (maggiormente suscettibile a sviluppare mutazioni che porteranno alla trasformazione).
SEDE: Le lesioni possono essere circoscritte e interessare le corde vocali, le false corde o l’epiglottide, a seconda del tipo di stimolo che c’è stato oppure possono essere così estese e confluenti da dare a tutta la mucosa un aspetto ispessito, tipo “pachidermico”.
- CONDILOMA PIANO
E’ analogo a quello osservato nella cervice uterina, lesione provocata da HPV e a volte anche da ceppi oncogenici e comporta una alterazione citopatica come quella del papilloma. Anche questa può essere una lesione precancerosa. Lesioni di questo tipo le vediamo anche nella bocca, nel palato, nell’ugula, nelle tonsille.
NEOFORMAZIONI MALIGNE LARINGE
- CARCINOMA IN SITU LARINGE
Il CARCINOMA IN SITU è una lesione che ancora non ha oltrepassato il limite della mucosa.
Si parla di LIN (neoplasia intraepiteliale laringea).
STADIAZIONE : (questa valutazione la facciamo su una biopsia che deve essere orientata e tagliata perpendicolarmente alla superficie).
Il carcinoma in situ si distingue tipicamente in tre stadi (1,2 e 3): 1 e 2 sono lesioni a basso rischio, mentre 3 è considerato una lesione ad alto rischio di diventare invasivo, in ogni caso merita un intervento chirurgico.
- LIN 1 le alterazioni cellulari si vedono soltanto nel terzo inferiore dell’epitelio
- LIN 2 metà spessore (ma non a tutto spessore)
- LIN 3 tutto spessore senza fenomeni di infiltrazione dello stroma.
MICROSCOPICO : Epitelio pluristratificato che poggia su una membrana basale.
E’ caratterizzata da alterazioni citologiche ad architettura caratteristica come la perdita della polarità cellulare, polimorfismo, ipercromia nucleare, mitosi negli stati superiori.
A livello del confine epitelio stromale c’è la membrana basale che si può vedere abbastastanza distintamente e c’è anche un infiltrato linfocitario importante, espressione della reazione dell’ospite che tende a limitare il processo patologico e tende a contenerlo.
- CARCINOMA SQUAMOSO LARINGE (O SQUAMOCELLULARE)
Il CARCINOMA SQUAMOSO è il tumore maligno più frequente tra i tumori testa-collo
INCIDENZA: V, VI, VII decade di età
SEDE:
- più frequente è alla regione della glottide (determina precocemente DISFONIA) ;La crescita in genere è esofitica, frequentemente il tumore è ulcerato; parte da una zona localizzata ma può sconfinare attraverso la commessura anteriore alla corda vocale controlaterale o può sconfinare anche alla porzione sovraglottica o sottoglottica.
- sovraglottici che sono al secondo posto, viene interessata l’epiglottide è molto coinvolto in questo caso il RGE o anche i fumo di tabacco che viene deglutito in gran parte. In questo caso il sintomo è la DISFAGIA (è un tumore che infiltra e compromette la motilità dell’epiglottide che deve essere elastica e facilmente abbassabile e allora può determinare delle piccole aspirazioni di bolo alimentare).
- Al terzo posto quelli sottoglottici che non danno segno di sé se non quando diventano così grossi da provocare DISPNEA oppure si ulcerano e danno l’EMOFTOE, però in questo caso il tumore è grande.
STADIAZIONE ISTOLOGICA:
- DIFFERENZIATO
- MODERATAMENTE DIFFERENZIATO
- SCARSAMENTE DIFFERENZIATO
ISTOLOGICAMENTE: si hanno strutture concentriche che sono le perle cornee date dal fatto che gli elementi ancora tendono a maturare e produrre citocheratina
METASTASI: Le metastasi sono soprattutto ematogene e ai linfonodi regionali.
In genere il fatto che ci sia una patologia metastatica del tumore del laringe non comporta un grosso peggioramento delle prognosi, in quanto questi tumori poi posso avere anche lo stesso una prognosi abbastanza buona.
Le metastasi a distanza sono soprattutto al polmone.
CLASSIFICAZIONE TNM NEOPLASIE LARINGEE
- CARCINOMA VERRUCOSO LARINGE
Carcinoma in cui si ha ispessimento della mucosa fatto di cellule quasi normali (è facile sbagliare e prenderlo per una lesione benigna), ma se viene asportato precocemente ha una prognosi ottima, se viene invece asportato tardivamente, quando ha dato metastasi è molto difficile da trattare perché non risponde né alla chemio né alla radioterapia perché è molto differenziato.
- FORME CARCINOMATOSE MENO FREQUENTI
- CARCINOMA A CELLULE FUSATE le cellule ricordano molto quelle di un sarcoma;
- CARCINOMA BASALOIDE
- CARCINOMI NEUROENDOCRINI : DIFFERENZIATI quindi CARCINOIDI,
MODERATAMENTE DIFFERENZIATI e SCARSAMENTE DIFFERENZIATI.
- (molto raro) ADENOCARCINOMA, che viene proprio dalle strutture ghiandolari accessorie.
- CARCINOMA ADENOIDE CISTICO chiamato CAC: pur essendo scarsamente atipico, ha la caratteristica di infiltrare molto a distanza e dare metastasi precoci un po’ dovunque, non risponde a niente e la sopravvivenza a 5 anni è quasi 0.
- CARCINOMA NEUROENDOCRINO A PICCOLE CELLULE.